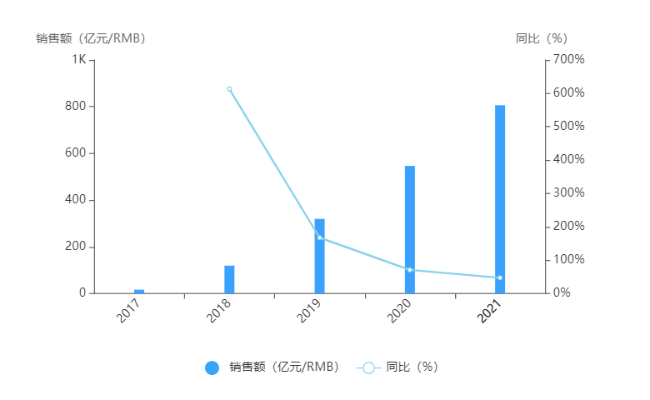
精彩內容 據美國食品藥品監督管理局(FDA)官方網站公布的最新數據,2020年12月FDA共批準7款創新藥物,包括5款新分子實體(NMEs)和2款新生物制品。2020全年,美國FDA總共批準了創新藥物53款,總數量趕超2019年,位列近十年FDA創新藥物榜單第二位。 圖1.近十
精彩內容
據美國食品藥品監督管理局(FDA)官方網站公布的最新數據,2020年12月FDA共批準7款創新藥物,包括5款新分子實體(NMEs)和2款新生物制品。2020全年,美國FDA總共批準了創新藥物53款,總數量趕超2019年,位列近十年FDA創新藥物榜單第二位。
圖1.近十年FDA批準的新藥數量

來源:FDA網站、公開資料
2020年12月美國FDA批準的7款創新藥物,分別是加州大學洛杉磯分校的Gallium 68 PSMA-11(Gallium 68 PSMA-11)、BioCryst公司的Orladeyo(berotralstat)、Athenex與Almirall合作的Klisyri(tirbanibulin)、MacroGenics公司的Margenza(margetuximab-cmkb)、Myovant Sciences公司的Orgovyx(relugolix)、Ridgeback Biotherapeutics公司的Ebanga(ansuvimab-zykl)和Urovant Sciences公司的Gemtesa(vibegron)。獲批的創新藥物涉及多個治療領域,包括2款抗腫瘤藥物、1款皮膚病用藥、1款泌尿系統用藥、1款心血管系統藥物、1款全身抗感染藥物和1款診斷用藥。
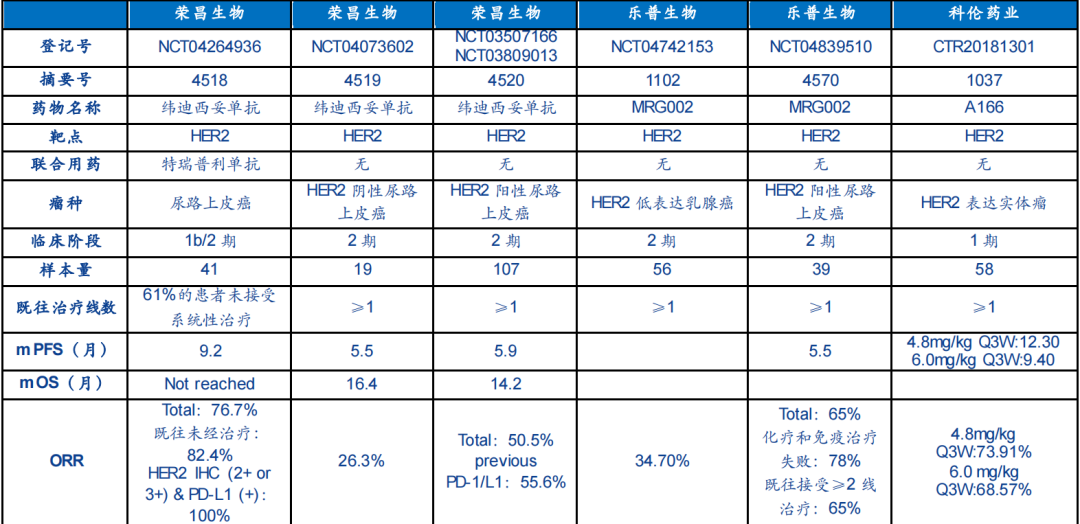
表1.FDA批準新藥的詳細信息

來源:FDA網站、米內網全球藥物研發庫
Gallium 68 PSMA-11(Gallium 68 PSMA-11)
2020年12月1日,美國FDA批準了加州大學洛杉磯分校的放射性診斷試劑Gallium 68 PSMA-11,用于PET成像診斷疑似前列腺癌轉移或復發的患者。Gallium 68 PSMA-11是首款獲得批準用于前列腺癌患者前列腺特異性膜抗原(PSMA)陽性病變PET成像的藥物。
圖2.Gallium 68 PSMA-11具體信息

來源:米內網全球藥物研發庫
前列腺癌是由于前列腺上皮處發生惡性腫瘤病變的一種惡性腫瘤,前列腺癌是美國第三常見的癌癥。據美國國家癌癥研究所估計,2020年美國前列腺癌新發病例將超過19萬,死亡人數預計達到3.3萬。雖然目前臨床常用診斷前列腺癌的成像方法是計算機斷層掃描(CT)、磁共振成像(MRI)掃描和骨掃描,但這些方法在前列腺癌病變的診斷上受到一定的限制。隨著Gallium 68 PSMA-11的獲批,醫務人員有了一種新的成像方法來檢測癌癥是否已經擴散到身體的其他部位。
Gallium 68 PSMA-11的安全性和有效性在兩項前瞻性臨床試驗中得到驗證,為此次批準奠定基礎。325例被認為有較高的轉移風險的前列腺癌患者參與了第一項臨床試驗,進行了手術切除前列腺和盆腔淋巴結的選擇,并用Gallium 68 PSMA-11進行了PET / CT或PET / MRI掃描。在繼續接受手術的患者中,Gallium 68 PSMA-11 PET在盆腔淋巴結讀數呈陽性的患者中經手術病理證實具有重要的臨床轉移率。在第二項臨床試驗中,有635位在最初的前列腺手術或放療后血清PSA水平升高的患者,其中74%的患者在至少1個身體區域中通過Gallium 68 PSMA-11 PET檢測到至少1個陽性病變。總的來說,Gallium 68 PSMA-11 PET讀數陽性的患者中,91%被證實前列腺癌局部復發或轉移。
Orladeyo(berotralstat)
2020年12月4日,美國FDA批準BioCryst公司開發的Orladeyo(berotralstat)上市,用于預防12歲及以上的兒童和成人遺傳性血管水腫發作。Orladeyo是一款新型的每日一次口服膠囊劑。這是首款被批準用于預防遺傳性血管水腫發作的靶向口服療法。目前,Orladeyo也正在接受歐盟和日本監管機構的審查。
圖3.berotralstat具體信息


來源:米內網全球藥物研發庫
此次批準主要基于名為APeX-2的關鍵3期臨床試驗,總共有120名成人和青少年患者參與其中。Orladeyo在治療第24周時顯著減少了遺傳性血管水腫發作,發生率在統計學上顯著降低,并且這種減少持續至第48周。完成48周治療(150mg)的患者中,遺傳性血管水腫發作率在基線檢查時為平均每月2.9次發作,治療48周后降低至平均每月1.0次發作。在長期開放標簽APeX-S試驗中,完成48周治療(150mg)的患者,平均每月發作0.8次。
遺傳性血管水腫是以反復發作自限性組織水腫為特征的一種罕見且嚴重的遺傳病,發病率大概1/50,000。臨床表現主要為的皮膚、呼吸道和內臟器官反復性腫脹經常會在不知不覺下發病。當水腫發生于氣道時,可致喉水腫,如果搶救不及時,可窒息死亡。當水腫發生于胃腸道,會類似急腹癥的表現,常誤診為闌尾炎、急性胰腺炎等,導致急診進行剖腹探查。目前,包括Orladeyo在內,FDA共計批準9款預防或治療遺傳性血管水腫的藥物。
表2.美國已上市的遺傳性血管水腫的藥物

Klisyri(tirbanibulin)
2020年12月14日,Athenex與Almirall合作開發的Klisyri(tirbanibulin)獲得美國FDA批準上市,用于局部治療面部或頭皮的光化性角化病。Athenex的首席醫學官Rudolf Kwan博士表示,Klisyri是治療光化性角化病的一種”first-in-class”微管抑制劑。2019年12月,香雪制藥與Athenex達成合作,獲得Klisyri在中國大陸、香港和澳門的獨家開發權利。
圖4.tirbanibulin具體信息


來源:米內網全球藥物研發庫
光化性角化病也稱為日光性角化病,是最常見的一種上皮性癌前皮膚病變。目前認為,反復、慢性的日光照射是光化性角化病的主要病因,好發于中老年人長期暴露于日光的面頸部,手背,前臂等部位。臨床表現為單發或者多發的境界不清的紅斑、淺褐色丘疹、角化性色素沉著等形態,表面常覆蓋有鱗屑,局部也可增厚呈現為疣狀丘疹或斑丘疹。歐洲、美國及澳大利亞有研究顯示,光化性角化病的患病率達 4.5%~60%。FDA的批準是基于兩項隨機雙盲、含賦形劑對照的關鍵性3期臨床試驗的數據,這兩項研究評估了Klisyri(tirbanibulin)軟膏在702名面部或頭皮光化性角化病成人患者中的療效和安全性。與對照組相比,在第57天,接受Klisyri治療患者中的面部或頭皮病灶完全清除的患者數量顯著提高。
Margenza(margetuximab-cmkb)
2020年12月16日,MacroGenics公司宣布,美國FDA批準其單抗Margenza(margetuximab-cmkb)上市,與化療聯用,用于已接受過2種或多種抗HER2方案治療、其中至少一種用于治療轉移性疾病的轉移性HER2陽性乳腺癌成人患者。2018年11月底,再鼎醫藥與MacroGenics達成戰略合作,獲得了3款免疫腫瘤學產品在大中華區的開發和商業化權利,其中就包括margetuximab。值得一提的是,Margenza是第一個在頭對頭3期臨床試驗中與羅氏的曲妥珠單抗相比顯著改善無進展生存期的HER2靶向療法,該藥的批準上市,將為HER2陽性轉移性乳腺癌患者群體帶來一種新的治療選擇。
圖5.margetuximab具體信息

來源:米內網全球藥物研發庫
Margenza的安全性和有效性在名為SOPHIA的3期臨床試驗中得到支持。這項研究共入組536名患者,與曲妥珠單抗聯合化療相比,Margenza聯合化療顯著降低疾病進展或死亡的風險。Margenza聯合化療的客觀緩解率為22%,曲妥珠單抗聯合化療的客觀緩解率為16%,具有統計學意義。
Orgovyx(relugolix)
2020年12月18日,Myovant Sciences公司藥物Orgovyx(relugolix)通過優先審查程序獲得美國FDA批準,用于治療晚期前列腺癌成人患者。Orgovyx是美國FDA批準用于治療晚期前列腺癌的首款口服促性腺激素釋放激素(GnRH)受體拮抗劑。
圖6.relugolix具體信息


來源:米內網全球藥物研發庫
根據美國癌癥研究協會預計,2020年美國將有超過19萬例前列腺癌患者。晚期前列腺癌的常用的治療方案之一是通過藥物降低幫助前列腺癌細胞生長的激素水平,也稱為是雄激素剝奪療法(ADT)。目前,FDA批準治療前列腺癌的ADT藥物僅有注射劑或皮下植入劑,Orgovyx是一種口服藥物,打破以往劑型上的局限。此次美國FD批準Orgovyx上市是基于一項名為HERO的3期臨床試驗結果。數據顯示,使用Orgovyx治療的患者在29天至48周的緩解率為96.7%,而使用亮丙瑞林微球作為對照的緩解率為88.8%。Orgovyx治療組在第8天就已經有91%的患者達到緩解標準,而亮丙瑞林微球組為0%。
Ebanga(ansuvimab-zykl)
2020年12月21日,美國FDA宣布批準Ridgeback Biotherapeutics公司開發的單克隆抗體Ebanga(ansuvimab-zykl)上市,用于治療成人和兒童的埃博拉病毒感染。這是繼再生元公司的中和抗體雞尾酒療法 Inmazeb (atoltivimab、maftivimaba and odesivimab-ebgn)在2020年10月獲批上市之后,FDA批準的第二款治療埃博拉病毒感染的藥物。
圖7.ansuvimab具體信息

來源:米內網全球藥物研發庫
埃博拉病毒是一種能引起人類和動物產生出血熱的烈性傳染病病毒,是迄今發現的致死率最高的病毒之一,致死率高達50%-90%,致死原因主要為中風、心梗、休克等,癥狀還包括發燒、頭痛、乏力、腹瀉、嘔吐、關節和肌肉疼痛等。埃博拉病毒主要在非洲地區流行,2013年至2016年期間西非地區埃博拉病毒的大規模爆發事件摧毀了幾內亞、塞拉利昂和利比里亞的公共衛生基礎設施,造成28,646人感染,11,323人死亡。
2018-2019年剛果民主共和國埃博拉疫情期間,Ebanga的安全性和有效性在名為PALM的多中心、開放標簽、隨機對照試驗中得到了評估。174例確診埃博拉病毒感染的受試者接受了Ebanga單次靜脈輸注,168例受試者接受了試驗對照的治療。主要療效終點為接受治療28天后的死亡率。在接受Ebanga治療的174例患者中,35.1%在28天后死亡,而在接受對照治療的168例患者中,49.4%在28天后死亡。
Gemtesa(vibegron)
2020年12月23日,Urovant Sciences公司的Gemtesa(vibegron)獲得美國FDA批準,用于治療治療伴有急迫性尿失禁、尿急和尿頻癥狀的膀胱過度活動癥成人患者。新聞稿指出, 這一批準是自2012年以來FDA批準治療這類患者的首個創新口服處方藥物。
圖8.vibegron具體信息


來源:米內網全球藥物研發庫
膀胱過度活動癥是一種以尿急癥狀為特征的綜合征,常伴有尿頻和夜尿癥狀,可伴或不伴有急迫性尿失禁;尿動力學上可表現為逼尿肌過度活動,也可為其他形式的尿道一膀胱功能障礙。近年,我國膀胱過度活動癥整體患病率隨年齡的增長顯著增高,41歲及以上的患病率為11.3%。Gemtesa是一款每日口服一次的β3腎上腺素能受體激動劑。研究表明, 它能夠選擇性地激活β3腎上腺素能受體,這是膀胱平滑肌中最常見的β腎上腺素能受體,從而舒張平滑肌,提高膀胱容量,進而減輕膀胱過度活動癥的癥狀。
此次批準,基于一項涉及4000多例膀胱過度活動癥患者的廣泛臨床開發項目的結果,其中包括一項關鍵的12周雙盲、安慰劑對照3期EMPOWUR研究(Gemtesa劑量為每日一次75mg)、雙盲EMPOWUR長期擴展研究。在EMPOWUR研究中,數據顯示,與安慰劑組相比,Gemtesa治療組患者每日UUI、排尿和急癥發作次數顯著減少,排尿量增加。
資料來源:FDA官網、企業公告、米內網數據庫
如有錯漏,敬請指正
本文來源:米內網 作者:皓月 免責聲明:該文章版權歸原作者所有,僅代表作者觀點,轉載目的在于傳遞更多信息,并不代表“醫藥行”認同其觀點和對其真實性負責。如涉及作品內容、版權和其他問題,請在30日內與我們聯系
 客服微v信:
客服微v信:








 京公網安備 11010802031568號
京公網安備 11010802031568號

